
Випробування стабільності ліків – це процес визначення терміну придатності фармацевтичних продуктів. Це включає в себе тестування лікарського засобу в різних умовах навколишнього середовища, таких як температура, вологість і освітленість, щоб оцінити реакцію ліків з часом. Результати випробувань використовуються для визначення гарантійного терміну придатності лікарського засобу.
Модель: TG-500GSP
Ємність: 500 л
Полиця: 4 шт
Колір: білий
Внутрішні розміри: 670×725×1020 мм
Зовнішні розміри: 850×1100×1930 мм
опис
Випробування на стабільність ліків - це тип кліматичної камери, яка використовується для перевірки стабільності фармацевтичних продуктів. Він призначений для імітації умов навколишнього середовища, яким можуть піддаватися ліки під час зберігання та транспортування. Рекомендації ICH містять вказівки щодо конструкції та роботи камери для випробування стабільності препарату, а також протоколи тестування, які слід використовувати.
Специфікація
|
Модель |
ТГ-150ГСП |
ТГ-250ГСП |
ТГ-500ГСП |
ТГ-800ГСП |
ТГ-1000ГСП |
|
Внутрішні розміри (Ш*Г*В) |
550×405×670 |
600×500×830 |
670×725×1020 |
800×590×1650 |
1050×590×1650 |
|
Зовнішні розміри (Ш*Г*В) |
690×805×1530 |
740×890×1680 |
850×1100×1930 |
1360×890×2000 |
1610×890×2000 |
|
Ємність |
150 л |
250 л |
500л |
800 л |
1000л |
|
Температурний діапазон |
Без світла 0~65°C, зі світлом 15~50°C |
||||
|
Коливання температури: ±0,5°C; Однорідність температури: ±2,0°C |
|||||
|
Діапазон вологості |
35% ~ 95% відносної вологості |
||||
|
Відхилення вологості |
±3,0% відносної вологості |
||||
|
Освітлення |
0~6000LX регульований ≤±500LX (Необмежене регулювання інтенсивності світла) |
||||
|
Контроль температури |
Збалансований спосіб регулювання температури |
||||
|
Контроль вологості |
Метод збалансованого регулювання вологості |
||||
|
Охолодження |
Два комплекти незалежних оригінальних імпортних герметичних компресорів автоматично перемикаються (LHH-80SD: один комплект) |
||||
|
Матеріал інтер'єру |
Антикорозійна нержавіюча сталь SUS#304 |
||||
|
Зовнішній матеріал |
Холоднокатаний сталевий лист з електростатичним порошковим напиленням |
||||
|
Ізоляція |
Надтонке скловолокно / поліуретан |
||||
|
Контролер |
Програмований LCD контролер |
||||
|
датчик |
Платиновий опір PT100 / ємнісний датчик вологості |
||||
|
Полиці |
3шт |
3шт |
4шт |
||
|
Споживання енергії |
2100 Вт |
2300 Вт |
3750 Вт |
7150 Вт |
7150 Вт |
|
Джерело живлення |
220В/50Гц |
380В/50Гц |
|||
|
Вставте міні-принтер |
1 комплект |
||||
|
Пристрої захисту |
Захист від перегріву компресора, захист від перегріву вентилятора, захист від перегріву, захист від надлишкового тиску компресора, захист від перевантаження, захист від нестачі води. |
||||
|
Умови праці |
+5~30℃ |
||||
Захист безпеки:
· Незалежний обмежувач температури: незалежне відключення та сигналізація для термічного захисту під час тесту.
· Система охолодження: захист компресора від перегріву, перевантаження по струму та надмірного тиску.
·Випробувальна камера: захист від перегріву, перегріву вентилятора та двигуна, обрив/зворот фази, синхронізація всього обладнання.
· Інше: захист від витоку та відключення, захист від перевантаження, звуковий сигнал тривоги, захист від витоку живлення та захист від перевантаження.
Крива температури та вологості:
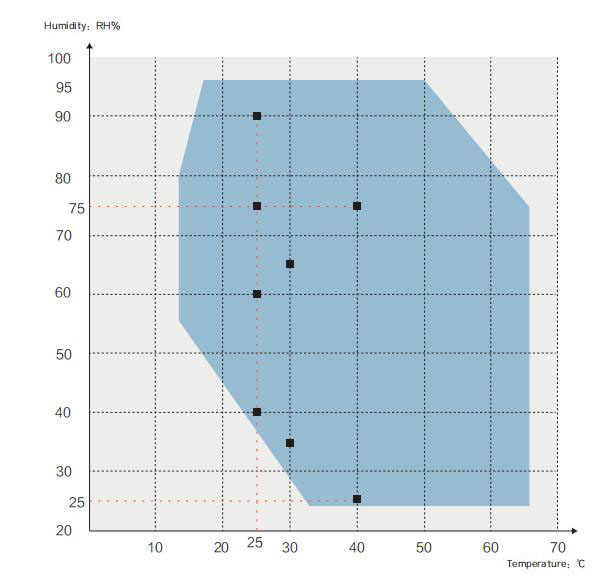
■Фармакопейні вказівки щодо стабільності лікарських засобів сировини та препаратів
Умови випробування температури та вологості, які вимагаються згідно з рекомендаціями ICH:
Температура навколишнього середовища для наступних випробувань повинна бути в межах 15~25 ℃
√Прискорений тест: 40℃±2℃ / 75%±5%RH, або 30℃±2℃/65%±5%RH
√Випробування на високу вологість: 25℃ / 90%±5%RH, або 25℃ / 75%±5%RH
√ Довгострокове випробування: 25 ℃±2 ℃ / 60%±5% відносної вологості або 30 ℃±2 ℃ / 65%±5% відносної вологості
√Для прискорених випробувань лікарських препаратів, упакованих у напівпроникні
контейнери, такі як пакети для інфузій, виготовлені LDB, пластикові ампули та окуляри
контейнери для підготовки тощо, випробування повинні проводитися при температурі 40 ℃ ± 2 ℃/25% ± 5% RH
√Для тривалих випробувань фармацевтичних препаратів, розфасованих у нап
у водопроникних контейнерах температура повинна бути 25 ℃±2 ℃/40%±5% відносної вологості або 30 ℃±2 ℃/35%±5% відносної вологості
Особливість
Які основні особливості тестування стабільності ліків?
Наступне може допомогти вам краще зрозуміти цю камеру:
1. Контроль температури: Тестування стабільності ліків може підтримувати точний контроль температури, діапазон температур може бути від -20°C до 70°C.
2. Контроль вологості. Рівень вологості всередині фармацевтичних камер стабільності можна налаштувати для імітації різної вологості. Це особливо важливо для чутливих до вологи препаратів, таких як певні типи твердих лікарських форм і біопрепаратів.
•Програмований сенсорний контролер
. 100 програм, 1000 сегментів, 999 кроків, 99 годин 59 хвилин на кожен сегмент.
. Функція автоматичного розрахунку P.I.D.
. Інтерфейс зв'язку RS485 / доступний вбудований принтер для зберігання даних і відтворення кривої історії.
. Запис даних і відображення діагностики несправностей, коли виникає несправність, причина несправності буде динамічно відображатися на контролері.

3. Контроль освітлення: деякі препарати чутливі до світла та можуть погіршуватися під впливом певної довжини хвилі світла. Таким чином, камера для випробування стабільності препарату Climatest Symor® має елементи керування освітленням, наприклад ультрафіолетове світло, щоб визначити вплив світла на лікарський продукт.
4. Циркуляція повітря: Тестування стабільності ліків має системи циркуляції повітря для підтримки постійної та рівномірної температури та вологості в камері.
5. Реєстрація та моніторинг даних. Тестування стабільності ліків оснащено датчиками та системами реєстрації даних, які відстежують і записують температуру, вологість та інші параметри навколишнього середовища, які можна використовувати для створення звітів і перевірки стабільності продукту.
Загалом камера для тестування на стабільність розроблена для того, щоб гарантувати, що ліки зберігаються та тестуються в контрольованих умовах навколишнього середовища, які імітують умови реального світу, а також для надання точних і надійних даних про стабільність для схвалення регуляторних органів.
Область тестування:
Зона тестування камери для тестування на фармацевтичну стабільність виготовлена з матової нержавіючої сталі SUS304 і призначена для імітації постійної температури, вологості або умов освітлення. Камера оснащена високоточними датчиками температури та вологості для моніторингу та підтримки цих кліматичних умов.
Існують стійки або полиці для зберігання зразків ліків, ці полиці регулюються по висоті, і зразки зазвичай поміщаються в щільно закриті скляні флакони або контейнери, щоб запобігти забрудненню.

Переваги тестування на стабільність ліків
Тестування стабільності ліків надає виробникам фармацевтичних препаратів багато переваг, зокрема:
. Забезпечення якості продукції: камери стабільності у фармацевтиці допомагають фармацевтичним компаніям перевіряти та вивчати якість своєї продукції, що має вирішальне значення для забезпечення її безпеки та ефективності протягом усього терміну придатності.
. Відповідність нормативним вимогам. Випробування на стабільність є важливою частиною регуляторного процесу схвалення фармацевтичних продуктів, а камера стабільності у фармацевтиці є важливою для виконання нормативних вимог.
. Підвищення ефективності виробництва: тестування на стабільність також може надати цінні дані про термін придатності нових складів продукту, які можуть стати основою для розробки та оптимізації продукту.
. Зменшення відходів продукту: тестування на стабільність може допомогти виявити продукти, які ризикують погіршитися або стати нестабільними, що може допомогти виробникам заощадити на виробництві.
Підсумовуючи, тестування стабільності ліків допомагає забезпечити якість продукту, відповідність нормативним вимогам, економічно ефективне тестування, покращити розробку продукту та підвищити продуктивність.
Роль тестування стабільності ліків
Тестування стабільності ліків розроблено відповідно до суворих нормативних вимог і галузевих стандартів, наприклад, встановлених Міжнародною конференцією з гармонізації (Рекомендації ICH). Камери можна використовувати для різних цілей, зокрема:
*Тестування стабільності при тривалому зберіганні: цей тип тестування використовується для визначення стабільності препарату протягом тривалого періоду часу, як правило, кількох років.
*Прискорене тестування стабільності: цей тип тестування використовується для оцінки стабільності препарату в суворих умовах, таких як високі температури та вологість, за короткий час.
* Тестування терміну придатності. Тестування стабільності ліків використовується для визначення терміну придатності препарату, який означає проміжок часу, протягом якого продукт може зберігатися за певних умов без втрати своєї сили, ефективності чи якості.
На основі результатів тестування на стабільність виробник може визначити термін придатності продукту та внести необхідні корективи до рецептури або упаковки, щоб забезпечити стабільність продукту протягом тривалого часу. Ці дані мають вирішальне значення для регуляторних органів, які використовують їх для визначення належних вимог до зберігання та поводження з препаратами.

Прискорене тестування на стабільність ліків
Прискорене тестування проводиться в звичайних умовах, і його мета полягає в тому, щоб прискорити хімічні або фізичні зміни лікарського засобу для перевірки, упаковки, транспортування та доставки. Нижче наведено приклад, який демонструє процедури прискореного тестування:
Застосовувана продукція: сировина та фармацевтичні препарати
Партії: 3 партії, ринкова упаковка
Умови зберігання: 40℃±2℃; 75%±5%
Термін зберігання: 6 міс
Оцінка: Візьміть зразки з 1-ї, 2-ї та 3-ї партій через 6 місяців, перевірте їх відповідно до встановлених стандартів якості, якщо вони не відповідають стандарту, то перевірте при 30°C±2°C, 65%+5 % за 6 міс.
Чутливі до температури препарати слід зберігати в холодильнику (4~8°C). Прискорене випробування можна проводити при 25°C±2°C; 60%±10%, 6 міс.
Сертифікати тестування на стабільність препарату Climatest Symor®
Сертифікати є офіційними документами, виданими виробниками або акредитованими сторонніми організаціями, вони підтверджують продуктивність і відповідність камери відповідним нормам і стандартам. Climatest Symor® має сертифікат ISO9001:2015, усі камери для випробування стабільності схвалені CE.

Фото монтажу на місці
Встановлення тестування стабільності ліків вимагає ретельного планування та уваги до деталей, щоб переконатися, що його встановлено належним чином
